CHIRURGIE CARDIAQUE
Insuffisance cardiaque
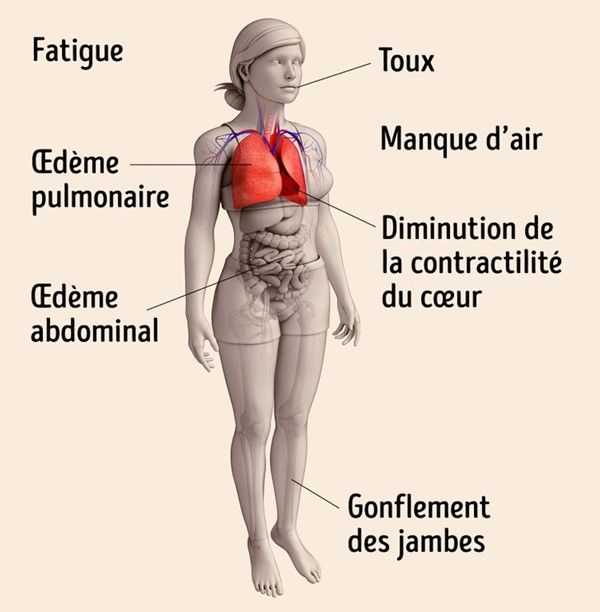 L’insuffisance cardiaque est un dysfonctionnement du muscle cardiaque entrainant l’apparition de symptômes (essoufflement, gonflement des membres inférieurs, fatigue), liés à la diminution du débit de sang ou l’élévation des pressions à l’intérieur du cœur.
L’insuffisance cardiaque est un dysfonctionnement du muscle cardiaque entrainant l’apparition de symptômes (essoufflement, gonflement des membres inférieurs, fatigue), liés à la diminution du débit de sang ou l’élévation des pressions à l’intérieur du cœur.
L’insuffisance cardiaque est schématiquement divisée en insuffisance cardiaque à fonction altérée (HFrEF – Heart Failure with Reduced Ejection Fraction) et insuffisance cardiaque à fonction préservée (HFpEF – Heart Failure with Preserved Ejection Fraction). Dans l’HFrEF, la fonction contractile du cœur est altérée, avec diminution du débit cardiaque et classiquement dilatations des cavités cardiaques. Dans l’HFpEF, la fonction de remplissage est altérée, avec une élévation des pressions cardiaques, engendrant des symptômes similaires.
Plusieurs étiologies peuvent engendrer l’insuffisance cardiaque et ces étiologies peuvent varier selon la région du monde concernée, l’âge et le sexe de la population étudiée. La maladie coronarienne est une des causes principales de l’insuffisance cardiaque en Belgique. De nombreuses autres causes peuvent engendrer ou concourir au développement de l’insuffisance cardiaque (intoxication, infection, maladie auto-immune, hypertension artérielle, maladies métaboliques…).
L’insuffisance cardiaque touche 1 à 2% de la population des pays développés, mais peut être supérieure à 10% au-delà de l’âge de 70 ans.
Prise en charge
La prise en charge de l’insuffisance cardiaque recouvre plusieurs aspects.
Premièrement, l’étiologie ou les causes doivent être identifiées avec exactitude, stabilisées et si possible traitées.
La prise en charge thérapeutique du patient nécessite également d’intervenir sur le style de vie du patient, avec maîtrise des facteurs de risques cardiovasculaires classiques (contrôle de l’hypertension, cessation du tabagisme, contrôle des valeurs glycémiques en cas de diabète, correction d’un excès de cholestérol ou de poids) et respect d’une hygiène de vie.
Les traitements cardiaques ou traitements médicamenteux (bêtabloquants, inhibiteurs du système rénine-angiotensine-aldostérone, diurétiques) constituent enfin une des pierres angulaires de la prise en charge des patients souffrant d’insuffisance cardiaque. Outre ces médications et la nécessité d’une bonne régularité de leur prise (« compliance thérapeutique »), une surveillance rapprochée auprès d’un cardiologue référent, une surveillance de leur poids et l’éventuel respect d’une restriction d’apport en liquides peuvent être nécessaires.
Dans certains cas ciblés et sévèrement atteints, le recours à un matériel implanté (défibrillateur, pacemaker resynchronisant les parois du cœur, l’implantation d’un matériel de support de la fonction cardiaque) peuvent être indiqués, voire le recours à une transplantation cardiaque.
Prise en charge chirurgicale de l’insuffisance cardiaque : assistance mécanique et transplantation

Le service de chirurgie cardiovasculaire du CHU de Liège est le centre référent régional en matière de transplantation cardiaque et effectue chaque année une demi-douzaine de greffes de cœur.
La prise en charge des patients est assurée par une équipe pluridisciplinaire comprenant : les coordinatrices de transplantation, les cardiologues, les chirurgiens cardiaques, les anesthésistes-réanimateurs cardiovasculaires, les intensivistes, les perfusionnistes et les infirmières spécialisées dans la prise en charge des patients souffrant d’insuffisance cardiaque.
La majorité des greffes est réalisée sur des sujets en état de mort encéphalique. Cependant, un des problèmes majeur en greffe de cœur est la pénurie de greffons. Afin d’augmenter le pool de greffons disponibles, l’équipe de transplantation du CHU de Liège a développé avec succès un programme de prélèvements de cœurs chez des donneurs en mort circulatoire.
Certains patients en attente de greffe cardiaque et dont l’état clinique se dégrade, peuvent bénéficier de l’implantation d’une assistance circulatoire de longue durée du cœur gauche (Heartmate III). Ce dispositif peu encombrant et silencieux est implanté à l’apex du ventricule gauche. Il réinjecte le sang dans l’aorte grâce à une pompe à débit continu qui est alimentée par des batteries externes par l’intermédiaire d’un câble électrique percutané. Ce système d’assistance monoventriculaire gauche est implanté en attente de transplantation ou de récupération du cœur (Figure 1 et 2).
Certains patients en attente de greffe cardiaque et dont l’état clinique se dégrade, peuvent bénéficier de l’implantation d’une assistance circulatoire de longue durée du cœur gauche (Heartmate III). Ce dispositif peu encombrant et silencieux est implanté à l’apex du ventricule gauche. Il réinjecte le sang dans l’aorte grâce à une pompe à débit continu qui est alimentée par des batteries externes par l’intermédiaire d’un câble électrique percutané. Ce système d’assistance monoventriculaire gauche est implanté en attente de transplantation ou de récupération du cœur (Figure 1 et 2).
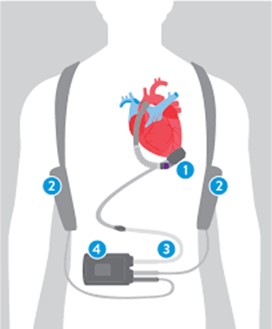
Figure 1. Composants du Système d’assistance ventriculaire gauche HEARTMATE 3.
1. La Pompe centrifuge implantée à la pointe du ventricule gauche.
2. Les batteries externes alimentent la pompe et offrent jusqu’à 17 heures d’autonomie.
3. Le câble d’alimentation qui relie la pompe au contrôleur et aux batteries externes.
4. Le contrôleur qui permet de réguler le fonctionnement de la pompe ainsi que son alimentation.
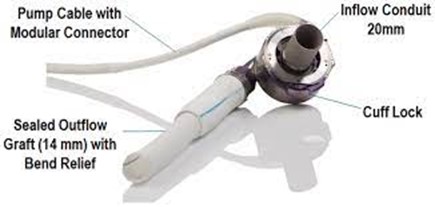
Figure 2. HEARTMATE 3
Pompe centrifuge implantée à la pointe du ventricule gauche et raccordée à l’aorte ascendante du patient via une prothèse de 14mm.
La Chirurgie valvulaire cardiaque

Une intervention de chirurgie valvulaire est très souvent nécessaire lorsqu’une des valves du cœur ne fonctionne pas correctement. Les valves cardiaques, au nombre de 4, ont pour mission de faire en sorte que le sang traverse le cœur dans une seule direction: les valves d’entrée (valve tricuspide à droite et valve mitrale à gauche) se ferment lorsque le ventricule se contracte pour éviter le retour du sang vers les oreillettes tandis que les valves de sortie (valve pulmonaire à droite et valve aortique à gauche) se ferment à la fin de la contraction pour éviter que le sang éjecté ne retourne dans le cœur.
Certaines maladies touchent les valves et empêchent leur fonctionnement correct. Si la valve ne s’ouvre pas correctement, elle constitue un obstacle à l’écoulement sanguin (on parle de rétrécissement ou sténose); si, par contre, elle ne se ferme pas correctement, le sang n’est plus éjecté dans une seule direction (on parle d’insuffisance valvulaire). Lorsque le rétrécissement ou l’insuffisance est important, un geste chirurgical s’impose. La chirurgie valvulaire cardiaque concerne essentiellement les valves aortique et mitrale, plus rarement tricuspide. La chirurgie de la valve pulmonaire est exceptionnelle.
Pour pouvoir travailler sur la valve malade, un arrêt complet des battements cardiaques est nécessaire. Dans ce cas, une circulation extracorporelle devra être utilisée : ce circuit externe remplace la fonction pompe du cœur et assure l’oxygénation du sang qui se fait normalement dans les poumons. La machine reprend donc, pour un certain temps, le rôle du cœur et des poumons qui peuvent être arrêtés. L’arrêt du cœur s’obtient par l’infusion dans l’organe d’une solution dite de « cardioplégie ». Le chirurgien peut alors en toute quiétude effectuer l’intervention de remplacement ou de réparation valvulaire.
Le traitement des maladies valvulaires est soit une réparation de la valve appelée « plastie». Si cette réparation n’est pas possible dans la plupart des cas, il faut changer la valve et la remplacer par une prothèse valvulaire. A partir d’un certain degré d’usure de la valve et en fonction de la gêne occasionnée, votre cardiologue vous conseillera de vous faire opérer.
Il existe 2 types de prothèses valvulaires :
– les valves mécaniques qui ont l’avantage de ne pas s’user avec le temps mais dont les inconvénients sont la nécessité d’un traitement anticoagulant à vie (qui fluidifie le sang et favorise les saignements) et un bruit constant mais généralement bien toléré.
– Les valves biologiques (fabriquées avec du péricarde de bœuf) qui ont l’avantage de ne pas nécessiter de traitement anticoagulant mais l’inconvénient de se dégrader en 15 à 20 ans.
Votre chirurgien vous aidera à choisir le type de valve le plus adapté dans votre cas.


La valve aortique
Le rétrécissement aortique est une maladie fréquente qui survient surtout chez les sujets âgés. Celle-ci est le siège de dépôts calcaires qui gênent son ouverture et créent un obstacle à l’éjection du sang à travers la valve aortique. Cette maladie est responsable le plus souvent d’un essoufflement à l’effort qui s’aggrave progressivement
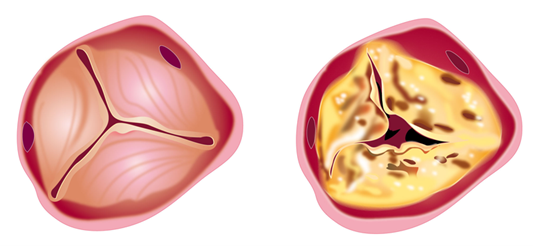
Valve normal Valve malade
Le Traitement
A partir d’un certain degré d’usure de la valve et en fonction de la gêne occasionnée, votre cardiologue vous conseillera de vous faire opérer.
Le traitement de cette maladie est le remplacement de la valve par une prothèse valvulaire. L’intervention se fait sous circulation extra-corporelle.
La valve mitrale
La valve mitrale se situe entre l’oreillette gauche et le ventricule gauche. À chaque battement de cœur, elle veille à ce que le sang oxygéné passe du ventricule gauche à la circulation sanguine sans reflux dans l’oreillette gauche.
- Si l’ouverture de la valve est très rétrécie (sténose mitrale ou rétrécissement mitral), le cœur est obligé de fournir plus d’effort pour envoyer le sang dans le ventricule gauche. À force, l’oreillette gauche se dilate, ce qui peut provoquer une fibrillation auriculaire. La tension artérielle augmente en outre dans la circulation pulmonaire (hypertension pulmonaire).
- Si la valve n’est plus étanche (insuffisance mitrale) : soit la valve mitrale elle-même peut être défectueuse, du fait par exemple de la rupture de l’un des cordages qui fixent les feuillets à la paroi du ventricule gauche. Soit la fermeture complète de la valve, pourtant intacte, est empêchée comme par exemple lors d’une insuffisance cardiaque où le cœur est si dilaté que la valve mitrale est étirée.
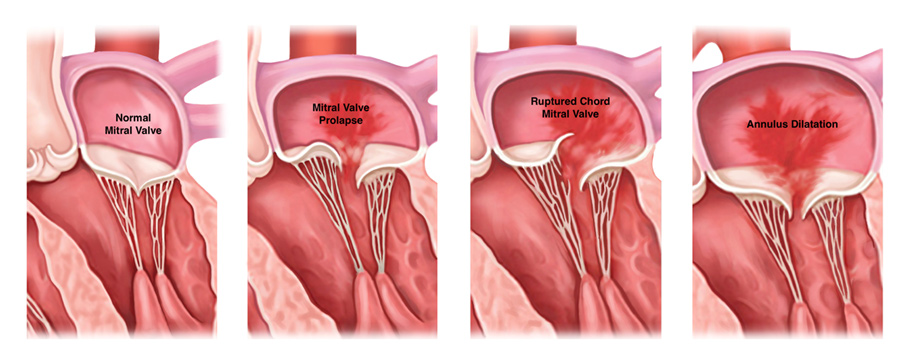
Le Traitement d’une maladie de la valve mitrale :
- Réparation ou reconstruction valvulaire mitrale (plastie mitrale) : on réduit par exemple l’ouverture avec la pose d’un anneau prothétique afin d’empêcher la valve de pouvoir de nouveau trop s’élargir.
- Remplacement de la valve mitrale. La valve mitrale est retirée puis remplacée par une valve prothétique mécanique ou biologique.
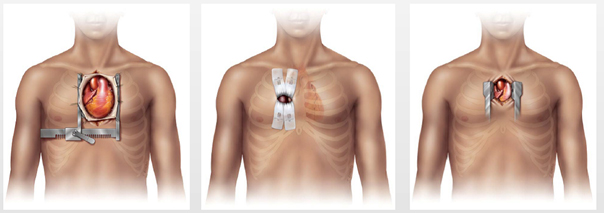
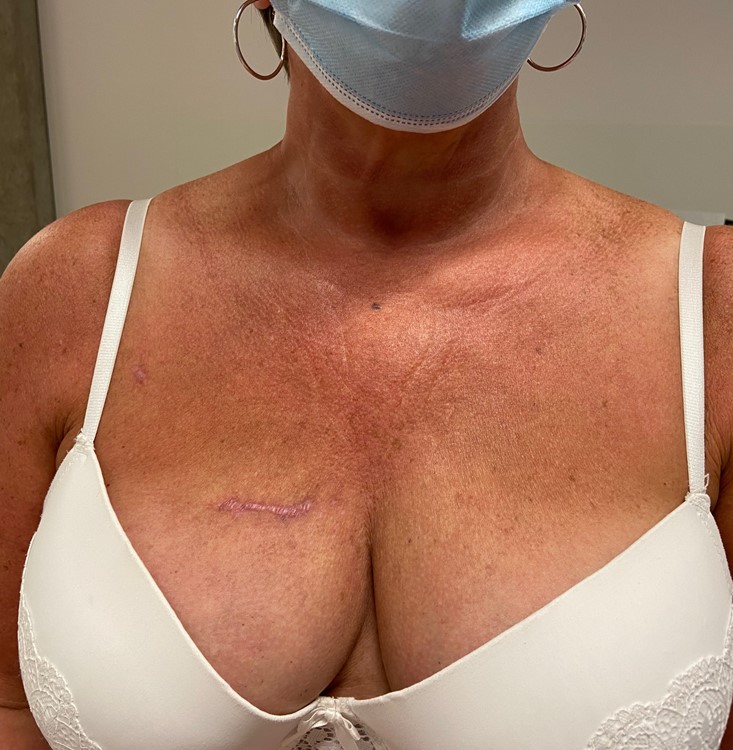
Il existe différentes voies d’abord (cicatrices) pour la chirurgie des valves cardiaques:
– la sternotomie qui consiste à ouvrir l’os en avant de la cage thoracique pour accéder au cœur ; de moins en moins utilisé.
– la mini-sternotomie qui consiste à réaliser une plus petite incision en ne coupant que la partie supérieure de l’os ;
– la thoracotomie droite qui est une petite cicatrice au-dessus du mamelon droit (5 cm) associée à une petite cicatrice au pli de l’aine, sans section osseuse, en passant entre les côtes. Les bénéfices de cette approche sont une amélioration des suites opératoires (douleur, pertes sanguines, transfusion), un rétablissement plus rapide (durée de séjour hospitalier plus courte, reprise plus précoce des activités) et un bénéfice esthétique.
LA CHIRURGIE CORONAIRE
L’apport en oxygène et en nutriments du cœur est assuré par les artères coronaires. Celles-ci forment trois branches principales et diverses branches secondaires.
Lorsque celles-ci sont le siège de rétrécissements (sténoses), l’apport en sang vers le cœur peut être compromis. Cela a pour conséquence une souffrance du muscle cardiaque qui se marque par l’apparition de douleurs thoraciques appelées « angine de poitrine » ou « angor » mais qui peut aussi se manifester sous la forme d’un essoufflement important. Chez certains patients, notamment diabétiques, des atteintes sévères peuvent être présentes sans symptôme. En l’absence de traitement, cette situation peut conduire à la survenue de la mort d’une partie du muscle cardiaque, c’est ce que l’on appelle l’infarctus. Cela peut conduire au développement d’une insuffisance cardiaque lorsque la capacité de contraction du cœur est diminuée.
Ces rétrécissements, lorsqu’ils sont importants, nécessitent donc un traitement qui consistera soit en la mise en place de stents par le cardiologue soit en la réalisation de pontages. Il a été démontré que chez certains patients les pontages apporteront un bénéfice plus grand que la mise en place de stents (atteinte des trois branches principales, patient diabétique,…). Le principe du pontage est d’amener du sang au-delà du rétrécissement. Pour ce faire, un conduit (greffon) doit être utilisé.
Différents conduits peuvent être utilisés :
– une artère qui longe le sternum dans la cage thoracique (artère mammaire interne),
– une artère de l’avant-bras (artère radiale),
– une veine prélevée au membre inférieur (veine saphène).
Plus de détail sur le prélèvement de l’artère radiale et de la veine saphène sont donnés ci-dessous.
Dans certains cas, en particulier pour l’artère mammaire, le conduit reste attaché à son origine. Dans certains cas pour l’artère mammaire et dans tous les cas pour la veine saphène et l’artère radiale, le conduit est branché sur l’aorte ou sur un autre vaisseau pour assurer l’apport en sang.
A cœur battant ou à cœur arrêté
La réalisation des pontages peut se faire sur un cœur dont les battements ont été arrêtés ou sur un cœur qui continue de battre (chirurgie à cœur battant). Chacune de ces techniques possède des avantages et inconvénients qui sont évalués pour chaque patient. La plupart des pontages réalisés le sont sur cœur arrêté. Dans ce cas, une circulation extracorporelle devra être utilisée : ce circuit externe remplace la fonction pompe du cœur et assure l’oxygénation du sang qui se fait normalement dans les poumons. La machine reprend donc, pour un certain temps, le rôle du cœur et des poumons qui peuvent être arrêtés. L’arrêt du cœur s’obtient par l’infusion dans l’organe d’une solution dite de « cardioplégie ».
Le nombre de pontage(s) nécessaire(s) est évalué avant l’intervention sur base de la coronarographie mais c’est pendant l’intervention que la décision finale est prise en fonction du calibre des artères du cœur et de la présence de calcifications importantes sur celles-ci.
La voie d’abord, la cicatrice
En fonction du nombre et du type de pontage(s) nécessaire(s), la chirurgie peut être réalisée en ouvrant l’os en avant de la cage thoracique pour accéder au cœur (le sternum), c’est la sternotomie ou par une petite incision sur le côté gauche en dessous de la poitrine, c’est la thoracotomie gauche.
Les bénéfices de cette deuxième approche sont une amélioration des suites opératoires (douleur, pertes sanguines, transfusion), un rétablissement plus rapide (durée de séjour hospitalier plus courte, reprise plus précoce des activités) et un bénéfice esthétique.
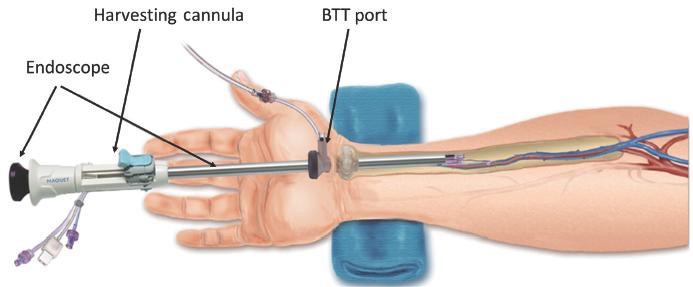
Les prélèvements endoscopiques de vaisseaux pour la chirurgie des pontages coronaires
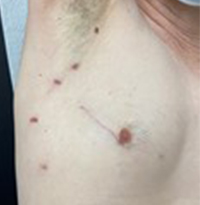
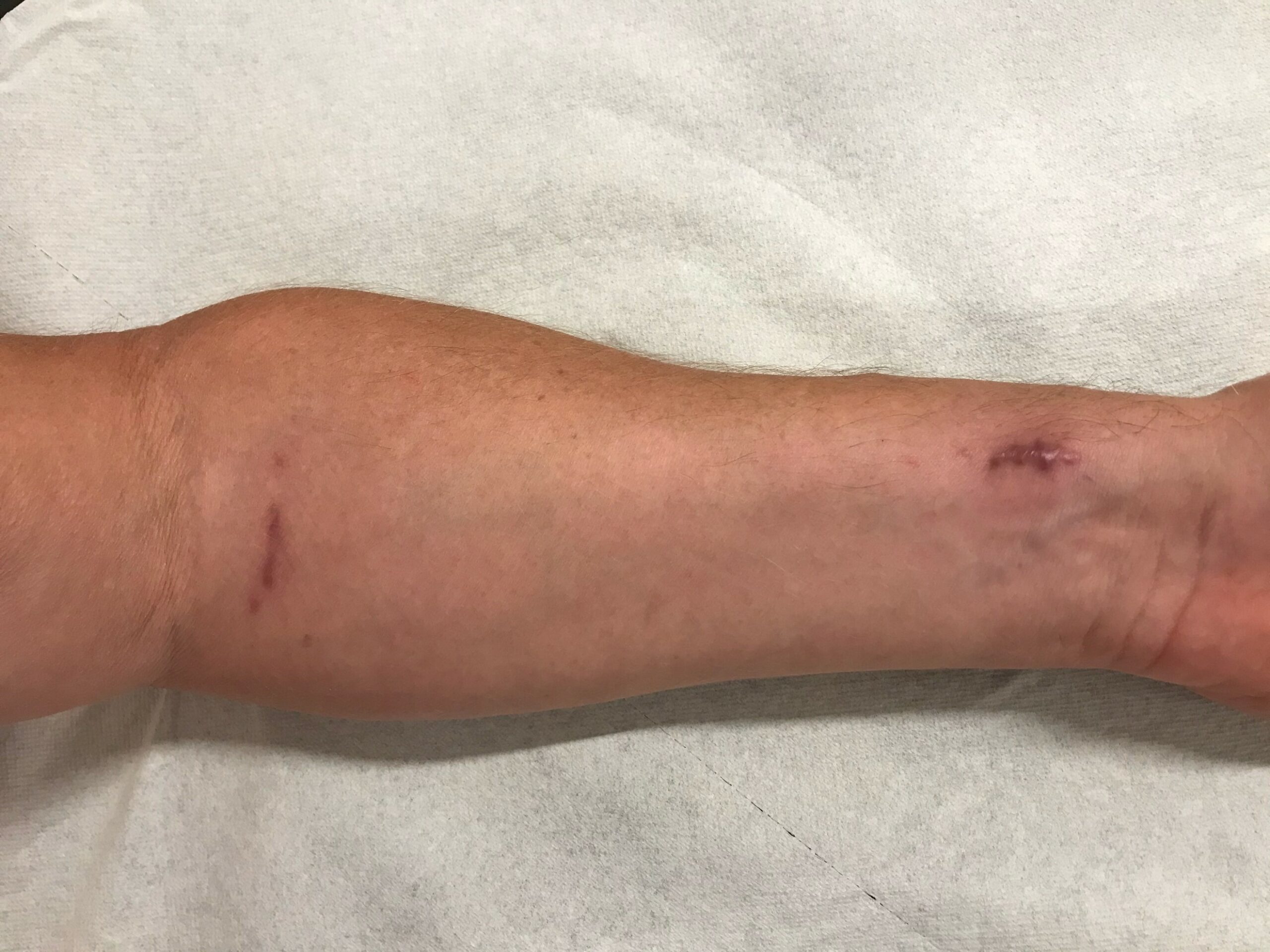
Pour la chirurgie des pontages coronaires réalisée par sternotomie classique, la technique classique de prélèvement des greffons autre que les artères mammaires, consiste à pratiquer une longue incision le long de la jambe pour accéder à la veine saphène ou le long du bras pour prélever l’artère radiale. En fonction des besoins, l’incision sera plus ou moins longue. Il n’est cependant pas rare qu’elle s’étende de la cheville à la cuisse ou du poignet au coude.
Nettement moins invasif, le principal avantage du prélèvement endoscopique de vaisseaux ou PEV (en anglais, Endoscopic Vascular Harvesting ou EVH) saphène ou radial est immédiat : la chirurgie classique requiert une incision qui peut atteindre 30 cm sur la face interne de la cuisse ou l’avant-bras, le PEV nécessite un ou deux abord de 2 centimètres. Cette voie endoscopique offre dès lors comme avantages pour le patient : des douleurs postopératoires limitées, moins de déhiscence de plaie et moins de sensations de fourmillements (paresthésies) ou de diminution de la sensibilité au niveau de la cicatrice. Ces avantages conduisent à une rééducation plus rapide en terme de mobilité, des soins postopératoires moindres, l’absence de longue cicatrice et un meilleur résultat esthétique, tandis que la qualité et la perméabilité du greffon sont similaires à celles obtenues après un prélèvement chirurgicale classique.
LES TUMEURS INTRA-CARDIAQUES
Une tumeur est de croissance anormale, maligne (cancéreuse) ou bénigne (non cancéreuse). Les tumeurs cardiaques peuvent être :
- Primitives (non cancéreuses ou cancéreuses)
- Métastatiques (toujours cancéreuses)
Les tumeurs qui trouvent leur origine dans le cœur sont appelées tumeurs cardiaques primitives et sont extrêmement rares. La plupart des tumeurs cardiaques primitives sont non cancéreuses (bénignes).
Tumeurs benignes
Les myxomes représentent la moitié de ces tumeurs bénignes. En deuxième position, on retrouve les lipomes et les fibroélastomes papillaires. Les myxomes surviennent un peu plus fréquemment chez la femme. La plupart des myxomes sont des tumeurs uniques essentiellement développées au niveau de l’oreillette gauche dans 70 à 80 % des cas ou de l’oreillette droite 15 à 20 % des cas. La plupart des myxomes sont appendus près de la fosse ovale, constituant des masses friables et plurilobées de diamètre variable. Un quart des myxomes est sessile avec une large base d’implantation. Les myxomes se manifestent par une obstruction valvulaire fluctuante, soit par des épisodes emboliques. Les découvertes systématiques se font après échocardiographie, TDM ou IRM. Le traitement est chirurgical et basé sur le principe d’une exérèse complète, notamment au niveau de la base d’implantation.
Les autres tumeurs cardiaques bénignes telles que les fibroélastomes, lipomes, tératomes, fibromes et hémangiomes sont le plus souvent des découvertes autopsiques. Dans la plupart des cas, les fibroélastomes valvulaires se présentent comme des masses gélatineuses type anémones de mer développées à partir des valves atrioventriculaires vers l’oreillette ou à partir de la valve aortique vers l’aorte. Les lipomes, à peu près aussi fréquents que les fibroélastomes, sont essentiellement développés au niveau de l’épicarde, du péricarde ou des cloisons septales. Les fibromes sont en général uniques et développés au niveau de la paroi antérieure du ventricule gauche ou du septum. Lorsqu’ils sont à l’origine de phénomènes obstructifs ou de troubles du rythme ventriculaire sévères, leur exérèse complète, notamment au niveau de la base d’implantation, s’impose.
Tumeurs malignes de l’adulte
Les tumeurs malignes représentent 20 % des tumeurs intracardiaques, leur pronostic est très grave, leur exérèse lorsqu’elle est possible prolonge un peu la survie, mais les patients meurent généralement dans les mois qui suivent dans un contexte de récidive ou de métastases.
Les sarcomes représentent 70 à 80 % de ces tumeurs malignes, ils peuvent se développer à l’extérieur du myocarde, se compliquant souvent de syndrome de tamponnade hémorragique, ils peuvent également se développer à l’intérieur des cavités cardiaques à l’origine d’obstructions valvulaires. Les sarcomes métastasent dans 80 % des cas le plus souvent vers les poumons.
Tumeurs métastatiques intracardiaques
Les localisations métastatiques intracardiaques, se rencontrent dans des autopsies.
Pratiquement tous les organes peuvent donner des localisations secondaires intracardiaques. Les primitifs les plus fréquents sont : les leucémies, les mélanomes, les lymphomes, les cancers du poumon et les cancers de l’œsophage.








